|
CHIMIEI-Inventaire et Classement Généralités Les «produits» de la nature contiennent des espèces chimiques qui sont utilisés directement après extraction ou indirectement après transformation dans l’industrie. Les «produits» fabriqués par l’industrie chimique contiennent eux aussi des espèces chimiques. L’homme
les fabrique: -en
les copiant sur des espèces chimiques existant dans la nature: -en
les créant de toutes pièces avec des ressources naturelles. II-Espèces chimiques naturelles
et synthétiques a-Quelques
espèces chimique naturelles -Les
espèces chimiques naturelles se trouvent dans la nature. Elles peuvent être
utilisées directement ou après extraction et purification d’un produit
naturel. -Les
huiles végétales comme l’huile d’olive, l’huile de tournesol
contiennent uniquement quelques espèces chimique s appelées corps
gras. Elles sont utilisées directement comme aliments ou dans
l’industrie comme matières premières pour fabriquer d’autres
produits comme le savon. -Le
bois contient 42% d’une espèce chimique appelée la cellulose
(essentiellement constituée de Carbone, d’Hydrogène et d’Oxygène)
extraire pour fabriquer des tissus. -Le
sucre extrait des betteraves sucrières ou de la canne à sucre contient
une espèce chimique appelée le saccharose. Ce dernier est le
sucre utilisé dans l’alimentation. -Le
menthol est à l’origine de la forte et fraîche odeur de menthe,
la pipérine donne au poivre son odeur et son goût piquant. -La vanille doit son goût et son parfum à une espèce chimique appelée vanilline,
l’isovanilline possède la même formule brute que la vanilline
mais pas le même arrangement des atomes. L’isovanilline, n’a aucune
odeur et une saveur plutôt désagréable. b-Quelques
espèces chimique synthétiques -La demande mondiale énorme et le prix de la vanilline naturelle ont fait que l’industrie a fabriqué la vanilline de synthèse: l’homme copie la nature. Actuellement, la plus grosse partie de la vanilline de synthèse est fabriquée à partir de la lignine, déchet de manufacture de la pâte à papier. -Le polystyrène expansé utilisé comme matériau d’emballage, le P.V.C. (polychlorure de vinyle) sont des espèces chimiques fabriquées par l’industrie chimique à partir de l’éthane. Ces espèce chimiques n’existent pas dans la nature. a-La
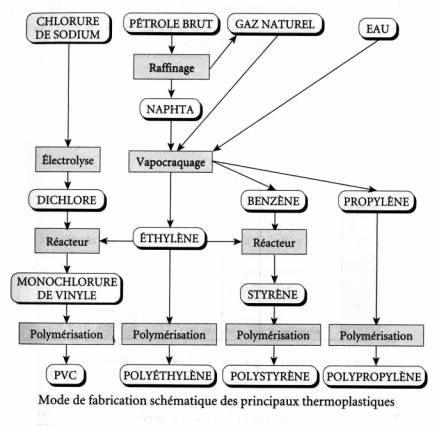
chimie lourde La fabrication des polyéthylènes à partir d’une espèce chimique est issue de la pétrochimie: L’éthylène. Il est fabriqué par vapocraquage des hydrocarbures (réaction avec l’eau à chaud et sous pression), eux mêmes obtenus par distillation des produits pétroliers. Par polymérisation, on obtient des polyéthylènes aux propriétés élastiques et plastiques remarquables. Les tonnages de fabrication sont impressionnants: Près de 80 millions de tonnes.
La chimie fine concerne la synthèse de copie de produits naturels (comme la vanilline) ou encore la production de produits pharmaceutiques (médicaments). Les quantités sont moins importants. La production mondiale annuelle de vanilline est de l’ordre de 9000 tonnes. -utilise
directement les produits naturels ; -transforme
les produits naturels en produits manufacturés ; -isole
les produits par extraction des espèces chimiques naturelles -copie
des espèces chimiques existant dans la nature ; crée
des espèces chimiques totalement nouvelles n’existant pas dans la
nature. III-Techniques d’Extraction a-Principe
de l’extraction par solvant.
Le
principe de cette technique repose sur le fait qu’un corps est souvent
plus soluble dans un solvant que dans un autre. L’extraction par
solvant consiste à extraire une ou plusieurs espèces chimiques d’un
produit, dans le solvant utilisé.
-une
espèce chimique ionique est plus soluble dans l’eau que dans un solvant
organique. -une
espèce chimique organique est plus soluble dans un solvant organique que
dans l’eau. -L’eau
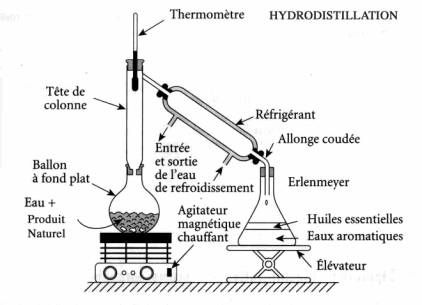
est utilisée comme solvant, elle dissout un certain nombre d’espèces
chimiques au cours de l’hydrodistillation. En fin de distillation, on
retrouve ces espèces chimiques dissoutes dans les eaux aromatiques*. -L’eau
sous forme de vapeur est utilisé comme corps d’entraînement des
huiles essentielles, les quelles ne sont pas solubles dans l’eau.
L’entraînement s’effectue le plus souvent à des températures inférieures
à 100°C. -Le distillat obtenu dans un erlenmeyer est composé de deux liquides non miscibles dont la couche supérieure possède un aspect huileux : c’est l’huile essentielle.
a-Séparation
par décantation.
b-Séparation
et identification. La chromatographie, effectuée à partir d’un dépôt sur le bas d’une feuille de papier ou sur une plaque de couche mince de silice (phase fixe), permet de séparer et d’identifier les différentes espèces chimiques constituant un mélange. La phase fixe est trempée sur sa partie inférieur dans un liquide appelé éluant, (phase mobile). Les différents constituants du mélange ne sont pas entraînés vers le haut avec la même vitesse. -sa
densité notée d donnée dans des ouvrages spécialisés, des
banques de données si le produit est déjà connu -sa
température de fusion mesurée au banc de Kofler (si le produit est un
solide) -sa
température d’ébullition mesurée avec une sonde ou un thermomètre
lors d’une distillation ou d’une redistillation (si le produit est
un liquide) -sa
couleur et/ou son odeur ; -sa
position sur une plaque (feuille ou silice) de chromatigraphie lors de
la comparaison avec des espèces chimiques connues. (en précisant l’éluant
utilisé) Si le
produit est connu, on compare l’ensemble des resultats obtenus avec
ceux de la littérature, s’il s’agit d’un produit nouveau c’est
à l’expérimentateur de detérminer et de communiquer les caractéristiques
physiques pour la première fois. La
chromatographie fait intervenir deux phases : la phase mobile et la
phase fixe. La phase mobile est constituée d'un solvant, et la phase fixe
d'un solide finement divisé (silice par exemple) qui peut être déposé
sur un support en aluminium ou en verre. -On
dépose le mélange d'espèces chimiques à séparer sur la phase fixe
(plaque de chromatographie) -On
place la plaque de chromatographie dans une cuve contenant l’éluent. -Lorsque
le solvant migre au contact de la phase fixe, il entraîne les espèces
chimiques du mélange à des vitesses différentes suivant que ces espèces
chimiques sont plus ou moins retenues par la phase fixe. Lors
d'une chromatographie, les espèces chimiques sont entraînées à des
vitesses différentes par la phase mobile. Les constituants du mélange
peuvent ainsi être séparés Télécharger Chimie en format Word | ||||||
|
| ||||||