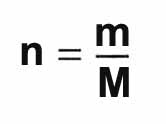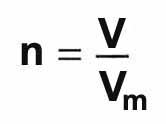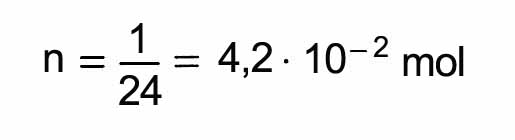|
|
LA MOLE I-La
mole, unité de quantité de matière a-Quantités
de matière microscopique et macroscopique Quand on considère les atomes de cuivre, on a une vision microscopique de la matière. Quand on considère le copeau de cuivre, on a une vision macroscopique de la même matière. Comment chiffrer une quantité de matière? Dans la vie quotidienne, le terme de quantité s'applique aussi bien au volume (quantité d'essence dans un réservoir), qu'à la masse (quantité de farine pour faire un gâteau), qu'à un nombre (quantité de billes). En chimie, la quantité de matière
est un nombre d'entités chimiques, c'est-à-dire un nombre
d'atomes, d'ions ou de molécules identiques. Les échantillons de matière manipulés en chimie comportent des nombres démesurés d'atomes (de l'ordre de 1022 ou 1023 atomes). Les chimistes ont cherché à éviter l'utilisation de tels nombres. b-La
mole Dans exactement 12 g de l'isotope 12 du carbone, il y a NA atomes de carbone 12. Bien que les chimistes aient longtemps pu se passer de connaître la valeur de NA, sa détermination fut un grand défi pour la science. Exemple: Les échantillons des espèces chimiques représentent des quantités de matière toutes égales à une mole. Cependant, les volumes occupés sont différents. De même, les masses sont différentes : 12 g pour une mole de carbone (ici sous forme de poudre noire), 63,5 g pour une mole de cuivre... c-la
constante d'Avogadro
La masse d'une mole d'atomes de carbone 12 est connue : c'est 12 g par définition, mais on a longtemps ignoré la valeur de NA et la masse d'un atome de carbone. On doit à Jean Perrin d'avoir déterminé NA pour la première fois en 1923. Le nombre NA a été appelé constante d'Avogadro en reconnaissance de la contribution apportée par ce savant aux progrès de la chimie. NA représentant le nombre d'entités par mole, on l'exprime en mol NA
= 6,022.1023 mol‑1 Une
mole, c'est un paquet de 6.1023 entités chimiques
identiques. Exemples: une mole de cuivre, d'eau et d'électrons contiennent respectivement 6.1023 atomes Cu, 6.1023 molécules H20 et 6.1023 électrons. II-Masse
molaire a-Masse
molaire atomique Exemples
: MC = 12,0 g.mol-1 pour le carbone 12, par définition, MO = 16,0 g.mol-1 pour l'élément chimique oxygène, MCl = 35,5 g.mol-1 pour l'élément chimique chlore. Les masses molaires atomiques figurent dans la classification périodique des éléments chimiques. Elles ont été déterminées expérimentalement. La masse d'une mole d'ions monoatomiques est
égale à la masse molaire atomique de l'élément chimique
correspondant. Exemples: MCl-
= MCl = 35,5
g.mol-1 MNa+
= MNa =
23,0 g.mol-1 b-Masse
molaire moléculaire La masse molaire moléculaire est la masse
d'une mole de molécules identiques. Elle est égale à la somme
des masses molaires atomiques des éléments chimiques qui la
constituent. La masse molaire moléculaire s'exprime aussi en g.mol-1 Exemple: calcul de la masse molaire moléculaire de l'eau. MH2O
= 2xMH + 1xMO = 2x1,0 + 1x16,0 = 18,0 g.mol-1 Exemple: masse d'une mole d'ions sulfate SO42- MSO42-
= 1xMS + 4xMO = 1x32,1 + 4x16,0 = 96,1 g.mol-1 La quantité de matière n d'une masse m
d'un échantillon de masse molaire M est donnée par la relation:
n
en mol m en g M en g.mol‑1 Exemple: calcul de la quantité de matière d'eau dans 1 L d'eau. La masse d'un litre d'eau vaut 1000 g. La masse molaire de l'eau est de 18,0 g.mol-1 La quantité de matière est donc donnée par n = m/M = 100/18 = 55,5 mol. III-Cas
des gaz Tout ce qui a été dit précédemment s'applique aux gaz. Mais nous allons voir que les échantillons de gaz ont des particularités qui simplifient considérablement les calculs de leur quantité de matière. Les
gaz sont, pour la plupart, constitués de molécules. L'étude de
différents gaz réalisée par Gay‑Lussac et Dalton conduit,
en 1811, le savant italien Avogadro à formuler l'hypothèse
suivante Ils
renferment donc le même nombre de moles. En d'autres termes, cela
signifie que 1 mol de gaz dihydrogène H2
et 1 mol de gaz butane C4H10,
à la même température et à la même pression, occupent le même
volume appelé volume
molaire. Suite à divers résultats expérimentaux et calculs, l'hypothèse est confirmée par Avogadro, puis par Ampère en 1814. Loi d'Avogadro-Ampère: dans les mêmes conditions de température et de
pression, tous les gaz ont le même volume molaire. Notes : Il peut paraître surprenant que des quantités de matière égales de gaz dihydrogène H2 et de gaz butane C4H10 par exemple, occupent le même volume alors que les molécules qui les composent sont différentes (Doc. 5.). b-Volume
molaire d' un gaz Puisque dans les mêmes conditions de température et de pression, une mole de n'importe quel gaz occupe toujours le même volume, il est utile de connaître ce volume molaire, noté Vm. Vm
= 22,4 L.mol-1 à 0°C et
à la pression atmosphérique normale. Vm
= 24 L.mol-1 à
20°C et à la pression
atmosphérique normale. Le
volume molaire dépend des conditions de température et de
pression. La
pression atmosphérique normale est la pression moyenne au bord de
la mer (altitude zéro). Avec les unités utilisées en météorologie,
elle vaut 1013hPa ou 760mm
de mercure (unité figurant
sur de nombreux baromètres). Il est plus commode de mesurer le volume d'un échantillon de gaz que sa masse. Il est donc utile de déterminer la quantité de matière n contenue dans un échantillon de gaz directement à partir de son volume V. La relation à utiliser est
On note que la réponse aurait été la même si l'on avait considéré du gaz argon, ou n'importe quel autre gaz dans les mêmes conditions.
| ||||
|
| ||||